Beginnen wir unseren dritten Teil dieser Reihe mal mit einer simplen Rechenaufgabe. Was ergibt 50 plus 50? Naja, das ist nicht sonderlich schwer: Das Ergebnis lautet 100. Doch ist das immer so? Die Antwort lautet nein! Zumindest nicht in der Chemie. Das ist überraschend, nicht wahr? Doch wie komme ich zu so einer gewagten Aussage? Betrachten wir hierfür mal die beiden miteinander mischbaren Flüssigkeiten Wasser und Ethanol, und lassen Sie uns ein Experiment machen. Wir messen in einem Messgefäß exakt 50 ml Wasser ab und in einem anderen Messgefäß genau 50 ml reines Ethanol. Gibt man diese beiden Flüssigkeiten in ein 100 ml Messgefäß zusammen, welches Gesamtvolumen erhält man dann? Die Antwort lautet nicht 100 ml! Es sind etwas weniger, nämlich 96 ml! Dieser Unterschied ist nicht groß, aber messbar. Was ist hier passiert?
Reale Mischung zweier Flüssigkeiten
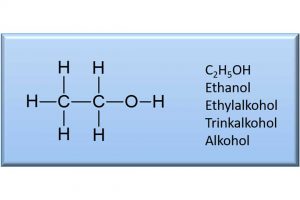
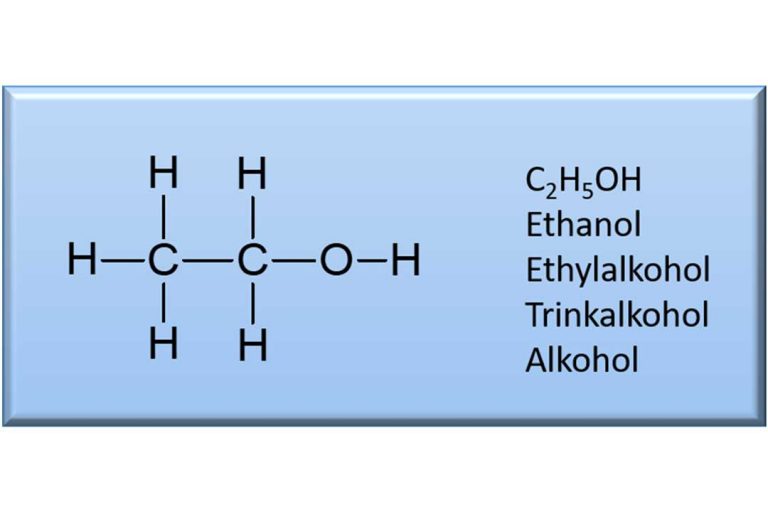
Der Grund hierfür ist, dass sich Wasser und Ethanol nicht wie eine ideale Mischung verhalten, denn dann wäre das Ergebnis exakt 100 ml. Wasser und Ethanol bilden ein sogenanntes „reales Gemisch“. Was heißt das? Kommen Wasser- und Ethanolmoleküle zusammen, so üben sie gegenseitig Wechselwirkungen aufeinander aus. Auf sie wirken sogenannte Bindungskräfte, die die Moleküle in der Mischung näher zusammenrücken lassen. Hinzu kommt, dass die beiden Moleküle unterschiedliche Größen haben. Das Molekül Wasser hat die chemische Formel H2O, besteht also nur aus zwei Wasserstoffatomen und einem Sauerstoffatom. Das Molekül Ethanol hingegen hat neun Atome. Zwei Kohlenstoff- und sechs Wasserstoffatome sowie ebenfalls ein Sauerstoffatom. Die Formel für Ethanol lautet C2H5OH. Neun Atome in einem Molekül beanspruchen mehr Raum als nur drei. Das Molekül Ethanol ist demnach deutlich größer als das kleine Wassermolekül. Die Moleküle im reinen Ethanol sind dreidimensional übereinander und nebeneinander angeordnet wie große Kugeln. Dadurch entstehen Räume zwischen diesen Kugeln, die ungenutzt bleiben. Mischt man nun Wasser dazu, so können sich die kleinen Wassermoleküle teilweise in diese Zwischenräume der Ethanolkugeln einnisten. Zusammen mit dem „Näherrücken“ der Moleküle durch die Bindungskräfte kommt es bei der Mischung von Ethanol mit Wasser zu der beobachteten Volumenkontraktion von 4 ml.
Inselbildung
Halten wir also fest, dass Wasser und Ethanol keine ideale Mischung darstellen. Man hat zudem wissenschaftlich festgestellt, dass die Ethanolmoleküle in der Mischung lieber unter ihresgleichen bleiben möchten. Soll heißen, in der Mischung mit Wasser sind die Ethanolmoleküle nicht gleichmäßig in der Flüssigkeit verteilt, sondern sie schließen sich zu mehreren kleinen Inseln, sogenannten Clustern, zusammen. Zu dieser „Inselbildung“ kommt noch hinzu, dass sie vom Mengenverhältnis abhängig ist. Man konnte nachweisen, dass sich bei Mischungen mit mehr Ethanol als Wasser, z. B. ab 59 Volumenprozent, diese Ethanol-Cluster bevorzugt in der Mitte des Flüssigkeitsgemisches in einem Glas oder Gefäß aufhalten. Ist der Anteil an Wasser in der Mischung größer – wir sprechen von einer Spanne zwischen 27 und 45 Volumenprozent – so wandern die Ethanol-Cluster mehr zur Flüssigkeitsoberfläche hin. Schön und gut, aber was bedeutet das für die Praxis? Nun, dazu müssen wir uns die dritten Moleküle im Bunde ansehen, die Aromastoffe.
Wasser- und fettliebend
In der Praxis sind Mischungen, bestehend aus Ethanol, Wasser und Aromastoffen, alkoholische Getränke. Beträgt der Anteil an Ethanol in der Mischung mindestens 15 Volumenprozent, so sprechen wir gemäß der EU-Verordnung vom 17. April 2019 von Spirituosen. Whisky ist so eine Spirituose. Sie enthält mindestens 40 Volumenprozent Ethanol, dazu noch eine Menge Wasser und einen geringen Anteil an verschiedenen Aroma- und Geschmacksstoffen, sogenannte Kongenere, die von den Einsatzstoffen und der Produktion herrühren. Diese Kongenere sind, ebenso wie Ethanol, organische Verbindungen. Sie bestehen ebenfalls aus einer unterschiedlichen Anzahl an Kohlenstoff-, Wasserstoff- und Sauerstoffatomen. Je nach Komplexität der Verbindungen können in ihnen auch noch Stickstoff- und/oder Schwefelatome enthalten sein. Die Art und Anzahl der Atome in einem Molekül entscheiden darüber, ob diese Verbindung insgesamt wasserlöslich ist oder nicht. Wasserlösliche Substanzen nennt man hydrophil. Das kommt aus dem Griechischen und bedeutet so viel wie wasserliebend. Hydrophile, also wasserlösliche Stoffe, sind oft gleichzeitig nicht fettliebend, also äußerst schlecht löslich in Ölen oder Fetten. Fettliebend wird in der Chemie lipophil genannt.
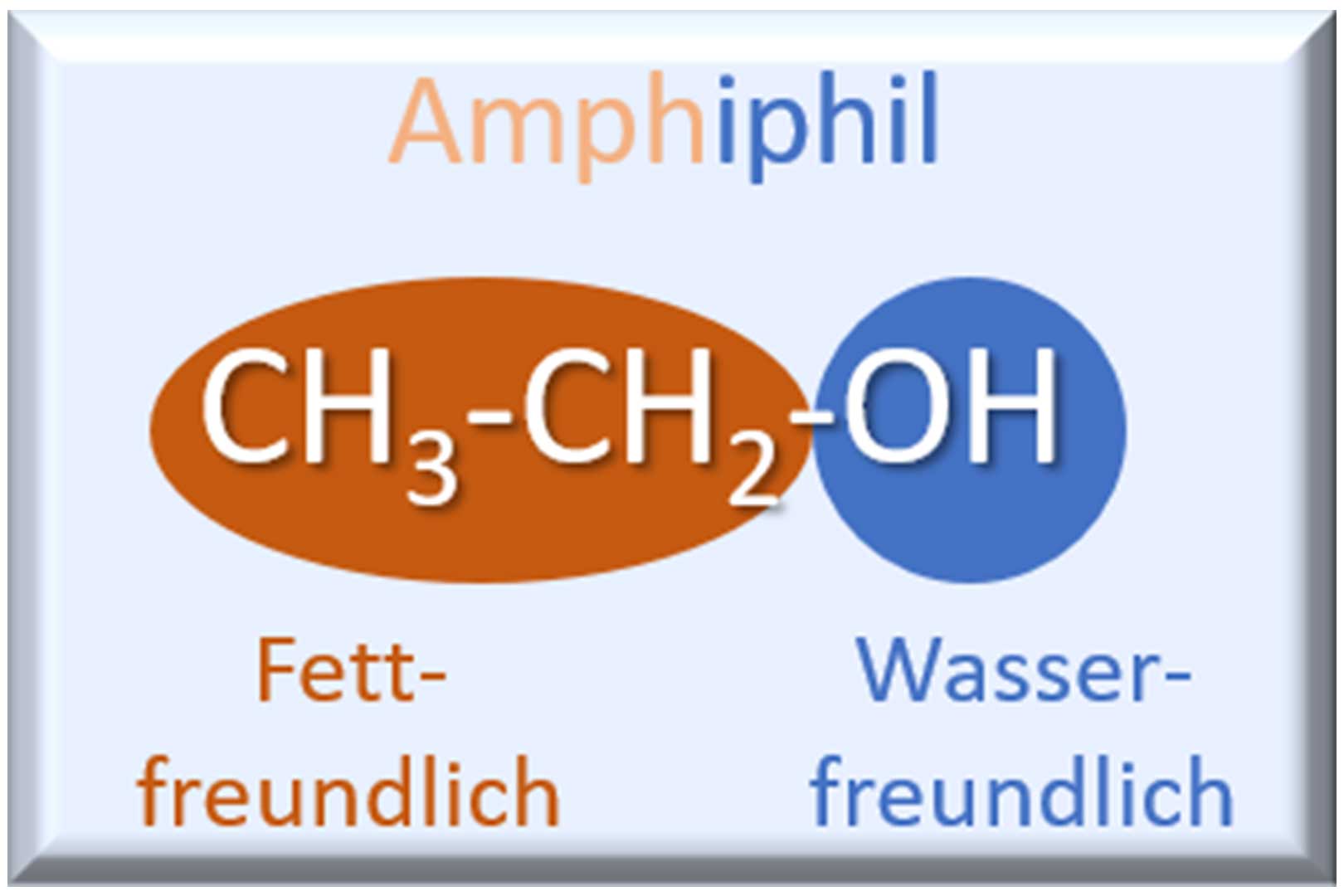
Amphiphilie
Nennen wir mal ein paar Beispiele. Wasser besteht nur aus Wasserstoff- und Sauerstoffatomen, und klar, es ist wasserliebend, also hydrophil. Ethanol hingegen besitzt zum einen die OH-Gruppe, die ebenfalls wasserliebend ist. Daneben ist in Ethanol noch die C2H5-Gruppe enthalten, die nicht wasserliebend, sondern fettliebend ist. Ethanol besitzt also im gleichen Molekül wasserliebende (hydrophile) und fettliebende (lipophile) Gruppen. Sprich, es hat sowohl eine hydrophile als auch eine lipophile Seite. In der Chemie haben wir für Moleküle mit einer derartigen Eigenschaft natürlich auch wieder einen passenden Namen parat: Wir nennen sie amphiphil. Dies ist ein lateinisch-griechisches Mischwort und bedeutet so viel wie beides liebend. Macht ja auch Sinn.
Aromastoffe und ihr Verhältnis zu Ethanol
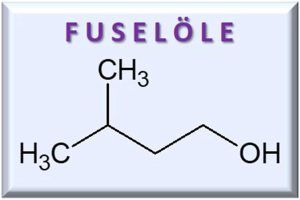
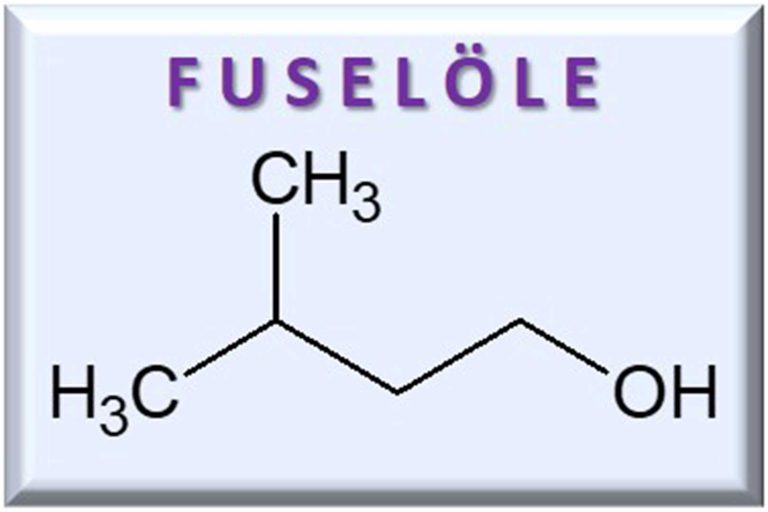
Das Ethanol steht mit seiner Eigenart nicht alleine da, denn die allermeisten Kongenere sind ebenfalls amphiphile Verbindungen. Die Aromastoffe, die beispielsweise im Whisky zu finden sind – wie Ester, Säuren, Phenole, Lipide, organische Schwefelverbindungen, Aldehyde, Lactone oder Fuselöle – enthalten in ihren chemischen Strukturen ebenfalls sowohl wasserlösliche als auch fettlösliche Gruppen. Eben genau wie Ethanol. Betrachten wir also jetzt unser Glas mit Whisky: eine Mischung aus Wasser, Ethanol und Aromastoffen. Da letztere genauso wie Ethanol amphiphil sind, werden sich die Aromastoffe eher nahe der Ethanolmoleküle aufhalten, als die Nähe zum Wasser zu suchen. Ganz nach dem Prinzip: gleiches zu gleichem! Das bedeutet, dass sich die Kongenere im Whisky bevorzugt um die Ethanol-Cluster herum versammeln. Diese Ethanol-Cluster halten sich – wie wir jetzt wissen – bei höheren Ethanolkonzentrationen von 59 Volumenprozent und mehr bevorzugt in der Mitte des Whiskys in unserem Glas auf. Daher nimmt man Aromastoffe mit der Nase, wenn man am oberen Glasrand riecht, weniger wahr, da sie sich, zusammen mit den Ethanol-Clustern, weiter weg von der Flüssigkeitsoberfläche befinden. Gibt man jedoch einige Tropfen Wasser zum Whisky hinzu, so dass sich die Ethanolkonzentration auf 45 Volumenprozent und darunter verringert, wandern mit den Ethanol-Clustern auch die Aromastoffe hin zur Flüssigkeitsoberfläche. Folglich können die Kongenere die Flüssigkeitsoberfläche leichter verlassen und in den Gasraum übergehen. Nun nimmt man die Aromen im verdünnten Whisky intensiver mit der Nase wahr. Wärmt man zudem das Whiskyglas mit der Handinnenfläche etwas an, so nutzen die Aromastoffe diese zugeführte Wärmeenergie, um noch leichter die Flüssigkeitsoberfläche verlassen zu können. Die Folge: Man riecht die Aromen noch intensiver!
Wie arbeiten professionelle Master Blender?
Diese vorgestellten Ergebnisse resultieren aus wissenschaftlichen Modellierungen mit dem Drei-Komponenten-System Wasser, Ethanol und dem Aromastoff Guajakol. Letzterer ist ebenfalls amphiphil, gehört zur chemischen Stoffklasse der Phenole und weist einen rauchig-medizinischen Geruch sowie brennenden Geschmack auf. Im Whisky haben wir es jedoch mit Hunderten von Aromastoffen zu tun. Die Realität sieht also deutlich komplexer aus. Doch das Prinzip der Ethanol-Clusterbildung, der Anordnung amphiphiler Aromastoffe um diese und der Wanderung der Cluster – abhängig von der Menge an Ethanol im Whisky – bleibt gleich. Aus diesem Grund arbeiten professionelle Master Blender bei der Beurteilung von Whisky, seien es Einzelfassabfüllungen oder Mischungen, mit verdünnten Proben. Der Whisky wird vor dem Nosing, also dem Verriechen, von den Master-Blendern mit Wasser auf etwa 20 Volumenprozent Ethanol verdünnt, da sich so der Charakter, die Aromen und der Geschmack des Whiskys am besten entfalten können. Hinzu kommt, dass dadurch die Aggressivität des Ethanols stark reduziert wird, die sonst Aromen überdecken kann. Außerdem würde man bei 40%igen Whiskyproben bereits nach kurzer Zeit nichts mehr riechen können, da Ethanol auch eine narkotisierende Wirkung haben kann.
Im nächsten Teil decken wir noch eine weitere interessante Eigenschaft von Ethanol auf. Seien Sie gespannt.