Vermutlich schon seit Menschengedenken wurde Alkohol hergestellt und getrunken. Erste Belege aus China für ein fermentiertes Getränk aus Reis, Honig und Früchten werden auf ca. 7.000 bis 6.600 vor Christus datiert. Alkoholische Getränke bilden sogar oft einen Mittelpunkt bei vielen der uns bekannten Kulturen. Doch woher kommt eigentlich der Name Alkohol? Wie entstand dieses Wort überhaupt? Nun, das Wort Alkohol ist in der Tat arabischen Ursprungs, obwohl es kurioserweise heute nicht in Wörterbüchern des klassischen Arabisch zu finden ist. Es leitet sich vom arabischen al-kuhl (auch al-kohl) ab – wobei al- der Artikel ist –, hatte aber zu der damaligen Zeit eine völlig andere Bedeutung. Mit al-kuhl bezeichnete man ein Pulver aus Antimonsulfid, ein natürlich vorkommendes Mineral, welches auch als Antimonglanz oder Grauspießglanz bekannt ist. Seit dem Altertum im Orient wurde eine angerührte Paste aus pulverisiertem Antimonsulfid und Wasser vor allem von Frauen zum Schminken verwendet, um sich die Augenbrauen, die Wimpern und den Rand der Augenlider schwarz zu färben. Als dann später die Europäer diese Substanz im südlichen Spanien kennenlernten, die auch zu medizinischen Zwecken verwendet wurde, bezeichneten sie diese – und allmählich auch alle anderen feinen Pulver und schließlich alle Arten von flüchtigen Essenzen – als Alkohol. In der Bedeutung alcohol vini, dem Geist bzw. der Essenz des Weines, kehrte das Wort dann später w in den arabischen Sprachraum zurück und wurde zu al-kuhul.
So der geschichtliche Hintergrund zum Wort bzw. Namen.
Schon sehr früh erkannte man unterdessen, dass Alkohol Bakterien abtötet und Lebensmittel konserviert. Aus biologischer Sicht ist Alkohol eine Energiequelle, denn etwa 10 Prozent der Enzyme in unserer Leber sind mit der Umwandlung von Alkohol in Energie beschäftigt. Und zu guter Letzt ist Alkohol wirtschaftlich von großer Bedeutung, denken wir nur an die vielen Whisky Destillerien nicht nur bei uns, sondern weltweit.
Doch was sind eigentlich Alkohole?
Chemisch gesehen sind Alkohole organische Verbindungen, die aus mindestens drei chemischen Elementen zusammengesetzt sind, die wir alle kennen: nämlich aus Kohlenstoff (wird in der Chemie mit dem Symbol C abgekürzt), Wasserstoff (H) und Sauerstoff (O). Das sind neben Stickstoff die wichtigsten Elemente in der organischen Chemie überhaupt. Das untrügliche Merkmal eines Alkohols ist seine OH-Gruppe, chemisch auch Hydroxylgruppe genannt. Jeder Alkohol besitzt eine solche OH-Gruppe. Sie prägt maßgeblich die Chemie der Alkohole. Das heißt, die OH-Gruppe ist für das Reaktionsverhalten dieser organischen Verbindungen verantwortlich. Dies ist wichtig und aus aromatischer Sicht von großer Bedeutung, wenn beispielsweise der New Make im Eichenfass zu Whisky heranreift. Doch dazu später mehr.
Ursprünge Kohlenwasserstoffe // Vier gleiche Nachbarn
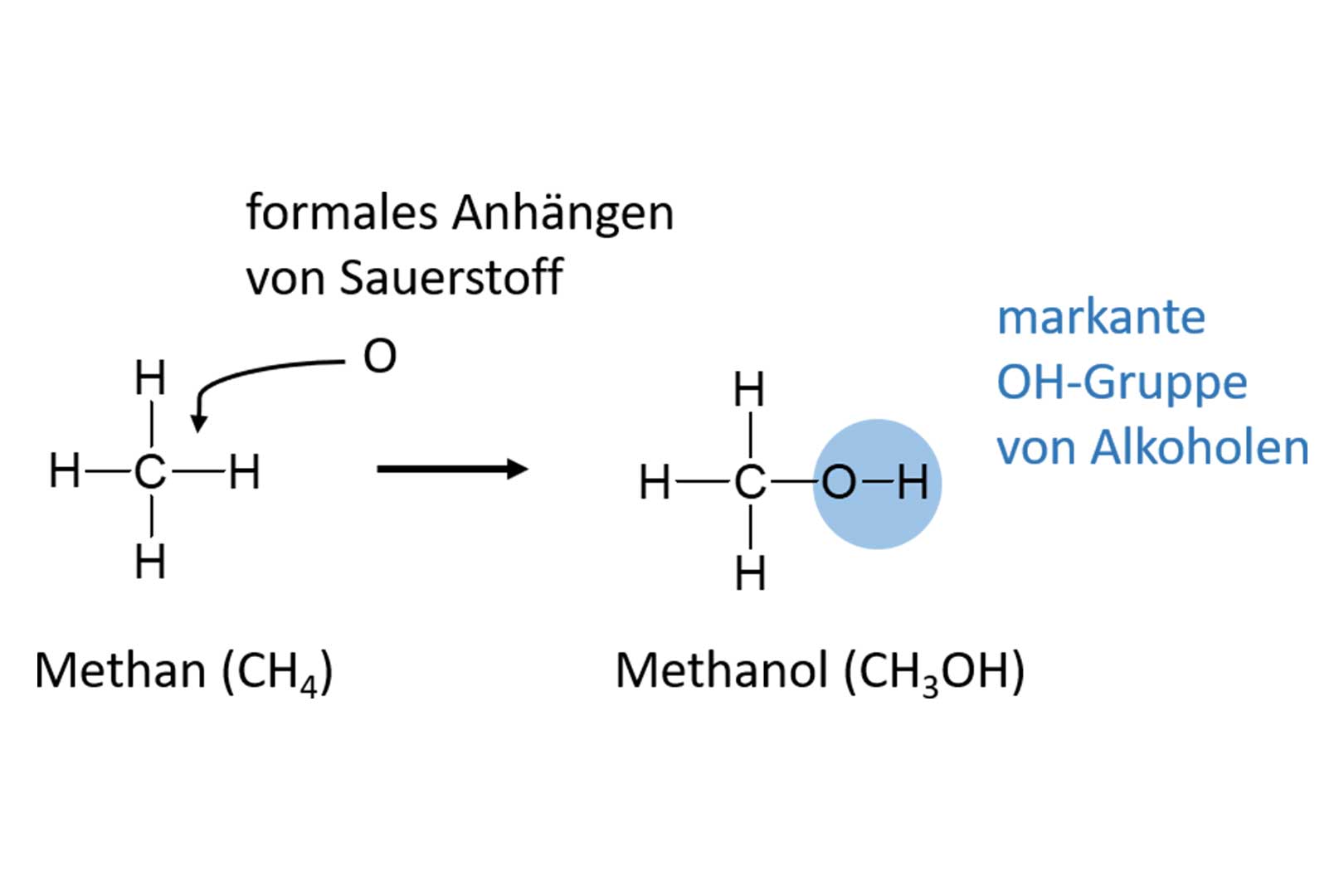
Jetzt interessiert uns vielmehr, wie wir zu den Alkoholen kommen. Dazu nehmen wir eine chemische Verbindung, die nur aus Kohlenstoff und Wasserstoff besteht, also ohne Sauerstoff. Solche Verbindungen nennt man Kohlenwasserstoffe. Der einfachste Kohlenwasserstoff ist Methan, ein farb- und geruchloses sowie brennbares Gas. Methan kennen wir. Als klimaschädliches Gas sorgt es schon längere Zeit für Schlagzeilen. Bei Methan hat der einzige Kohlenstoff, chemisch betrachtet, vier gleiche Nachbarn, nämlich Wasserstoffe. Somit ergibt sich für Methan die chemische Formel CH4, also ein Kohlenstoff umringt von vier Wasserstoffen. In der organischen Chemie gilt generell, dass jeder Kohlenstoff maximal vier Nachbarn haben darf. Dabei ist es egal, ob es gleiche oder unterschiedliche Nachbarn sind. Bei Methan liegt der Fall vor, dass alle vier Nachbarn gleich sind.
Markierungspunkt: Die -OH Gruppe
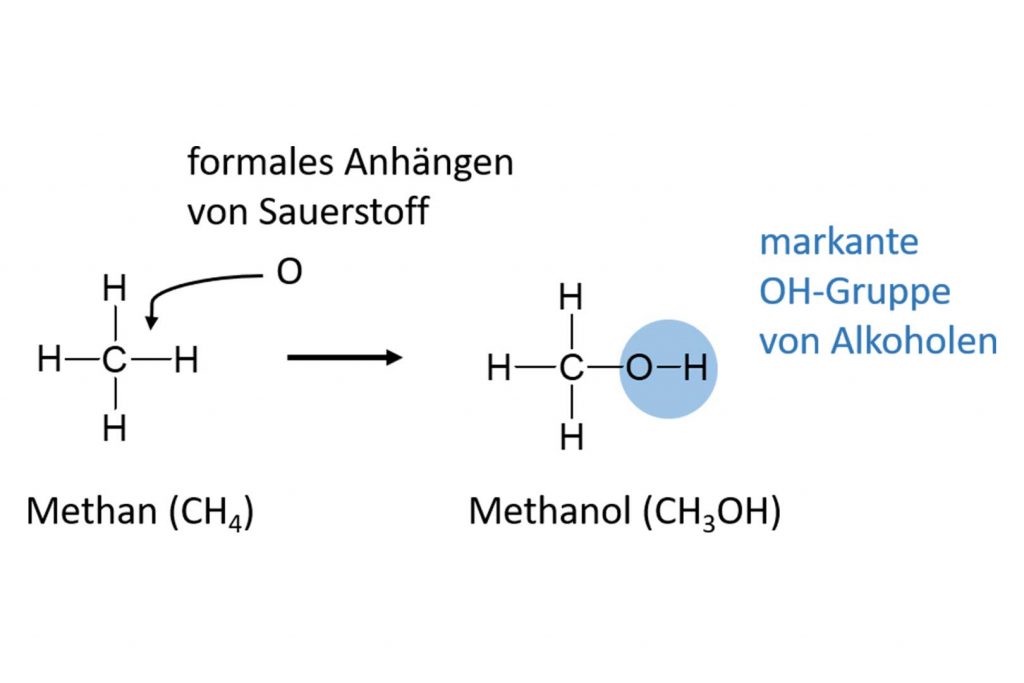
Um von Methan zum entsprechenden Alkohol zu kommen, wenden wir nun einen einfachen Trick an. Wir fügen dem Methan noch das Element Sauerstoff hinzu. Das geschieht in der Art, dass sich der Sauerstoff im Methanmolekül formal zwischen den Kohlenstoff und einen Wasserstoff schiebt. Addiert man demnach zu Methan, also CH4, ein O dazu, erhält man die Formel CH4O. Um gleich zu signalisieren, dass es sich dabei um einen Alkohol handelt, schreibt man die Formel etwas um, in dem man die OH-Gruppe – wie wir ja jetzt wissen, ist sie das markante Merkmal eines jeden Alkohols – hervorheben. So wird aus CH4O die Formel CH3OH. Und schon haben wir unseren ersten Alkohol. Aus Methan wird der Alkohol Methanol. Das Methanol ist giftig und bekannt als eine niedrig siedende Flüssigkeit, die bei der Destillation von Obstbränden oder Whisky im Vorlauf überdestilliert.
Nächste Kohlenwasserstoffe & ihre Alkohole
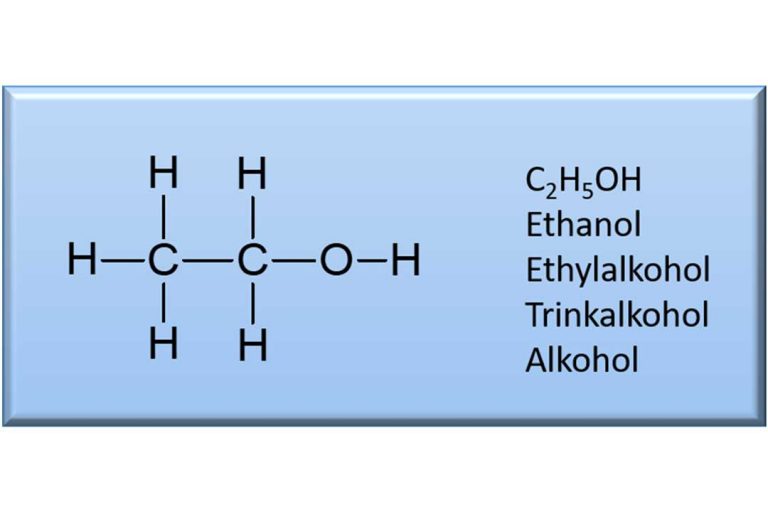
Der nächste Kohlenwasserstoff mit nunmehr zwei Kohlenstoffen heißt Ethan, ebenfalls ein Gas. Dessen chemische Formel ist C2H6. Fügt man auch hier einen Sauerstoff hinzu, entsteht eine Verbindung mit der Formel C2H6O bzw. in Analogie zu oben C2H5OH. Ja, und das kennen wir doch alle. Das ist Ethanol! Der Trinkalkohol, den die Hefe während der alkoholischen Gärung produziert. Und so geht es systematisch weiter. Aus dem hochentzündlichen Gas Propan (drei Kohlenstoffe, C3H8) wird Propanol (C3H7OH) und, man ahnt es schon, aus Butan (vier Kohlenstoffe, C4H10) wird das mit einem weinartigen Geruch behaftete Butanol (C4H9OH). Und so weiter und so fort.
Gedanklicher Zwischenstopp: Alkane
Man muss sich diese komplizierten Formeln nicht unbedingt alle merken, es genügt, wenn man die allgemeinen chemischen Formeln dieser Verbindungen im Kopf hat. Die Kohlenwasserstoffe haben in der Chemie noch einen anderen Namen, nämlich Alkane, daher auch die Endung -an bei Methan, Ethan, Propan, Butan, etc. Die allgemeine Summenformel für diese Alkane lautet CnH2n+2, wobei n eine natürliche Zahl ist, beginnend mit 1. Probieren wir es aus. Für n = 1 bekommen wir CH4, das Methan. Für n = 2 erhält man C2H6, das Ethan. Für n = 3 lautet das entsprechende Alkan C3H8, das Propan, und für n = 4 ergibt sich C4H10, das Butan. Passt wunderbar!
Ergo gilt: Von Alkan zum Alkohol…
Wie oben beschrieben, gelangt man von den Alkanen zu den Alkoholen durch formales Hinzufügen von Sauerstoff. Probieren wir es auch hier mit der allgemeinen Formel aus. Aus CnH2n+2 für die Alkane wird demnach CnH2n+2O für die Alkohole. Da wir die OH-Gruppe bei den Alkoholen wieder hervorheben wollen, wird CnH2n+2O zu CnH2n+1OH. Auch hier machen wir mal die Stichprobe. Für n = 1 erhalten wir CH3OH, das Methanol. Bei n = 2 lautet die Formel C2H5OH, also Ethanol. N = 3 liefert uns C3H7OH, das Propanol, und für n = 4 bekommen wir C4H9OH, das Butanol. Passt also auch hier.
.. und der Zauber der Summenformel
| Alkan | Summenformel | Alkohol | Summenformel | N |
| CnH2n+2 | CnH2n+1OH | |||
| Methan | CH4 | Methanol | CH3OH | 1 |
| Ethan | C2H6 | Ethanol | C2H5OH | 2 |
| Propan | C3H8 | Propanol | C3H7OH | 3 |
| Butan | C4H10 | Butanol | C4H9OH | 4 |
Was vielleicht auffällt ist, dass sich die Benennung, also die Nomenklatur der Alkohole, an den zugrundeliegenden Kohlenwasserstoffen, also den Alkanen, orientiert. Es wird lediglich die Silbe -ol an den entsprechenden Namen des Alkans angehängt. So wird also aus Methan Methanol, aus Ethan Ethanol, aus Propan Propanol und aus Butan Butanol, und so weiter. Das gilt also für alle von den Alkanen abgeleiteten Alkohole. Da soll noch einer behaupten, Chemie wäre kompliziert.
Weitere Unterscheidungsmerkmale: primärer, sekundärer und tertiärer Alkohol
Wie wir jetzt also wissen, ist das markante Merkmal eines Alkohols dessen OH-Gruppe. Diese hängt immer an einem Kohlenstoff. Entscheidend ist dabei, mit wie vielen anderen Kohlenstoffen dieser unmittelbar verbunden ist. Denn das unterscheidet die drei Möglichkeiten für unterschiedliche Arten von Alkoholen: nämlich primärer, sekundärer und tertiärer Alkohol. Um das besser zu verstehen, mache ich mal ein paar Beispiele: Nehmen wir z. B. den Alkohol Propanol. In der unten aufgeführten Strukturformel von Propanol erkennt man, dass der Kohlenstoff (rot markiert), an dem die OH-Gruppe hängt, nur mit einem weiteren Kohlenstoff (grün markiert) verbunden ist. Die beiden anderen direkten Nachbarn des rot markierten Kohlenstoffs sind Wasserstoffe (blau markiert). Das nennt man folglich einen primären Alkohol.

Auch die uns bekannten Methanol, Ethanol und Butanol sind primäre Alkohole, denn an dem (roten) Kohlenstoff hängt jeweils maximal ein weiterer (grüner) Kohlenstoff. Sind mit dem rot markierten Kohlenstoff, welcher die OH-Gruppe trägt, jedoch zwei grün markierte Kohlenstoffe verbunden, so spricht man von einem sekundären Alkohol. Ein Beispiel wäre das 2-Propanol, auch Isopropanol genannt, das u. a. als Frostschutzmittel im Scheibenwischwasser bei Autos zum Einsatz kommt. Und bei einem tertiären Alkohol hat der rot markierte Kohlenstoff, an dem die OH-Gruppe hängt, gar drei direkte grün markierte Kohlenstoffpartner. Beispiel wäre hier das 2-Methyl-2-propanol, der einfachste Vertreter der Stoffgruppe der tertiären Alkohole.
Alkohole & Oxidationen (Fassreifung)
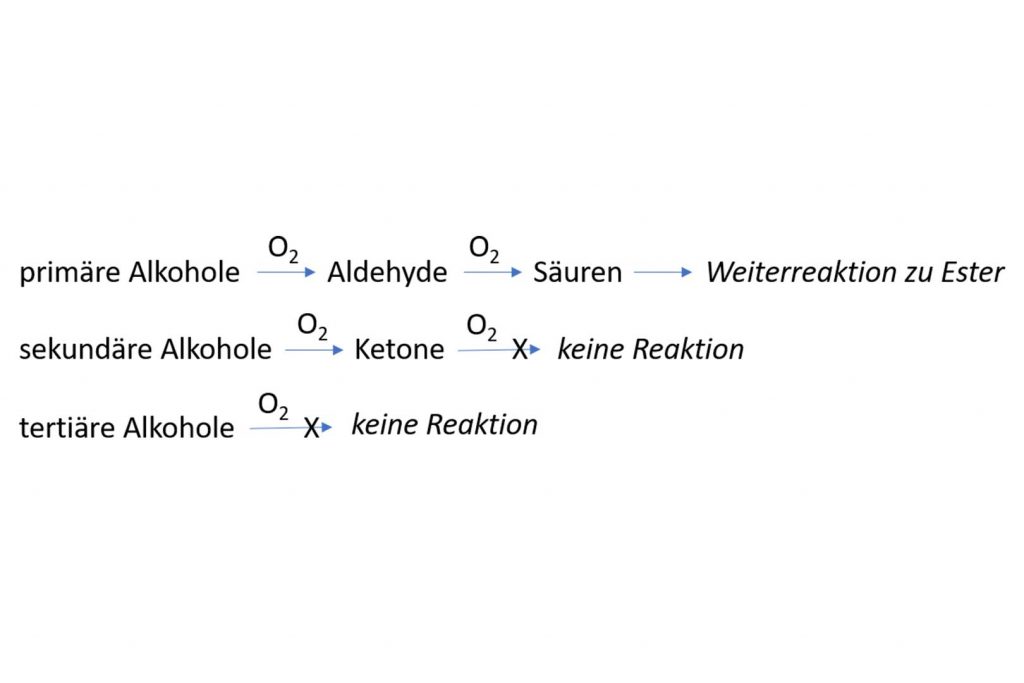
Warum habe ich diesen zugegebenermaßen doch recht komplizierten Sachverhalt überhaupt erwähnt? Nun, dies ist für die späteren Reaktionen der Alkohole von großer Bedeutung. Denn Alkohole können unter dem Einfluss von molekularem Sauerstoff (O2), der sich in der Luft befindet, oxidiert werden. Das Ergebnis dieser Oxidation ist abhängig davon, ob der Alkohol ein primärer, sekundärer oder tertiärer Alkohol ist. Beispiele? Primäre Alkohole können mit Sauerstoff zu einer neuen „Stoffklasse“ oxidiert werden, die man Aldehyde nennt. Diese Aldehyde wiederum können weiter zu einer anderen „Stoffklasse“, den Säuren, oxidiert werden. Diese Säuren haben dann die Möglichkeit, zusammen mit anderen Alkoholen fruchtige Ester zu bilden, die wir im gereiften Whisky beispielsweise als Pfirsich-, Bananen- oder Ananasgeruch bzw. -geschmack wahrnehmen.
Sekundäre Alkohole hingegen können nur einmal mit Sauerstoff oxidiert werden und zwar zu der als Ketone bezeichneten Stoffklasse. Ein Beispiel wäre die Oxidation von Isopropanol zu einem Keton mit dem Namen Aceton, das für den typischen Geruch von Nagellackentferner verantwortlich ist. Das alles passiert im Eichenfass während der Reifung, denn hier gelangt der Luftsauerstoff über die Poren der Eichendauben ins Fassinnere und kann über den langen Zeitraum der Reifung solche Oxidationen bewirken. Anders als die Aldehyde können die Ketone jedoch mit Sauerstoff nicht mehr weiter oxidiert werden. Die tertiären Alkohole ebenfalls nicht, denn sie gehen mit Sauerstoff überhaupt keine Reaktion ein.
So, ich glaube, das muss jetzt erst einmal verdaut werden. Beim nächsten Mal sehen wird uns dann den aus unserer Sicht als Whiskyliebhaber wohl wichtigsten Alkohol überhaupt an, nämlich das Ethanol…