Vor der flächendeckenden Verfügbarkeit von Kohle war auf den britischen Inseln Torf oftmals die einzig verfügbare Heizquelle – sowohl für die Privathaushalte als auch für die Whisky-Destillerien. Mittlerweile wurde Torf längst durch andere fossile Brennstoffe wie etwa Kohle, Öl oder Gas ersetzt. Während zwar das ein oder andere Haus insbesondere auf den abgelegenen Inseln auch heute noch ganz oder teilweise mit Torffeuer beheizt wird, kommt in einer Brennerei Torf nur noch dann zum Einsatz, wenn es darum geht, das Grünmalz zu aromatisieren. Dies ist zum Beispiel bei Bowmore, Kilchoman oder Laphroaig auf der Hebriden-Insel Islay der Fall, die jeweils einen Teil ihres Malzbedarfs durch eine eigene, traditionelle Mälzerei selbst herstellen.
Im getrockneten Zustand sind die bräunlichen Torfstücke nahezu geruchlos. Erst beim Verbrennen entwickeln sie ihr charakteristisches Aroma, das mit dem Rauch auf das zu trocknende Grünmalz übergeht. Denn im Torffeuer entstehen jene berühmten Phenole, von denen insbesondere die „Peatheads“ aller Herren Länder fast schon ekstatisch schwärmen. Grund genug, diese Phenole aus chemischer Sicht einmal gründlich unter die Lupe zu nehmen. Darauf freue ich mich schon seit Start dieser Reihe!
Was sind Phenole?
Ja, was verbirgt sich eigentlich hinter diesen berühmten Begriff, den bestimmt schon jeder von Ihnen, liebe Leserinnen und Leser, in Zusammenhang mit rauchigem Whisky gehört hat? Bemüht man das Internet, dann lernt man dies: „Phenole stellen chemische Verbindungen dar, die aus einem aromatischen Sechsring und mindestens einer daran gebundenen Hydroxygruppe bestehen“. Ja sicher, mit einer soliden chemischen Grundkenntnis ausgestattet kann man das durchaus verstehen. Aber, das können wir nicht bei jedem Whiskygenießer voraussetzen. Deshalb lassen Sie uns diesen ohne Frage auf den ersten Blick recht komplizierten Satz gemeinsam Stück für Stück gemeinsam auf den Grund gehen.
Als Sechsring bezeichnet man eine ringförmige Anordnung von insgesamt sechs Kohlenstoffatomen, die wir in der Chemie mit dem Symbol C (englisch für Carbon) abkürzen. Diese Kohlenstoffe hängen jeweils über eine chemische Bindung zusammen, die durch einen einfachen Strich zwischen den C-Atomen symbolisiert wird. Am Ende formt sich aus den sechs C-Atomen ein geometrisches Gebilde, das einer Bienenwabe ähnelt. Der Begriff „aromatisch“ zeigt an, dass drei der sechs Kohlenstoff-Kohlenstoff-Bindungen im Ring doppelt sind. Dies kennzeichnen wir in der chemischen Formel mit einem doppelten Strich zwischen den C-Atomen. In unserem Sechsring sind die Kohlenstoff-Atome also abwechselnd mit drei Einfachbindungen und drei Doppelbindungen verbunden.
Der Weg zur vereinfachten Darstellung
Jedes C-Atom im aromatischen Sechsring hat bereits drei Bindungen zu seinen unmittelbaren Nachbaratomen. In der Chemie ist Kohlenstoff jedoch vierbindig, das heißt: Kohlenstoff kann insgesamt vier Bindungen zu seinen Nachbarn ausüben. Sofern also kein weiteres Atom an einem Kohlenstoff hängt, erfolgt die vierte Bindung zu einem Wasserstoff-Atom H (englisch für Hydrogen). Die „Lücken“ werden sozusagen mit „neutralen“ H-Atomen aufgefüllt. Diese Wasserstoff-Atome haben für das weitere Reaktionsverhalten von organischen Verbindungen in den allermeisten Fällen keine große Bedeutung. Da wir Chemiker einen ausgeprägten Sinn für Übersichtlichkeit haben, lassen wir beim Zeichnen der Formel diese H-Atome einfach weg. Das C-Atom wird ebenfalls nicht gezeichnet, sondern befindet sich imaginär an der „Kreuzung“ zweier Bindungsstriche. So zeichnet der Chemiker für Benzen also ein gleichseitiges Sechseck (= Sechsring) mit drei abwechselnden Doppelbindungen (siehe Grafik rechts!).
Vom Benzol…
Ein aromatischer Kohlenstoff-Sechsring mit sechs zusätzlichen H-Atomen hat die chemische Formel C6H6 und wird als Benzol bezeichnet. Zumindest zu meiner Studienzeit war das so. Heute heißt diese Verbindung Benzen und stellt gewissermaßen den Prototyp für alle aromatischen Verbindungen in der organischen Chemie dar.
.. zu den Phenolen
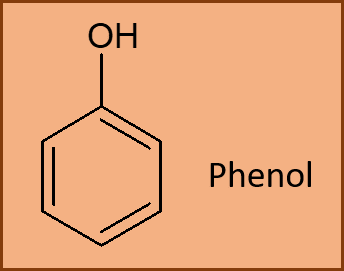
Aber, wir sind ja bei den Phenolen. Deren maßgebliches Erkennungsmerkmal ist die sogenannte Hydroxygruppe, die in der Chemie mit dem Symbol „OH“ abgekürzt wird. Diese Hydroxygruppe hängt an einem der sechs C-Atome im Ring. Dabei ist es egal an welchem, denn im Benzen sind ja alle C-Atome gleich. Es hat sich eingebürgert, dass man beim Zeichnen der chemischen Formel das oberste C-Atom mit der Hydroxygruppe verknüpft. Aber wie gesagt, jede andere Position im Sechsring kann ebenso mit der OH-Gruppe verbunden werden.
Auf diese Weise erhalten wir für das Phenol die chemische Formel C6H5OH, da ein H-Atom im Benzen durch eine OH-Gruppe ersetzt wurde. Dieses Phenol hat auch gleich der gesamten Stoffklasse ihren Namen gegeben. Das bedeutet also, dass alle Verbindungen mit einem aromatischen Kohlenstoff-Sechsring und mindestens einer damit verbundenen OH-Gruppe als Phenole bezeichnet werden. Beim Verbrennen von Torf entsteht im Rauch aber nicht nur das Phenol, sondern eine Vielzahl von phenolischen Verbindungen, bei denen ein oder mehrere H-Atome an den Kohlenstoffen im Phenol durch unterschiedliche Atome oder Gruppen ersetzt sind. Der Chemiker spricht hier von Derivaten.
.. und dessen Derivate
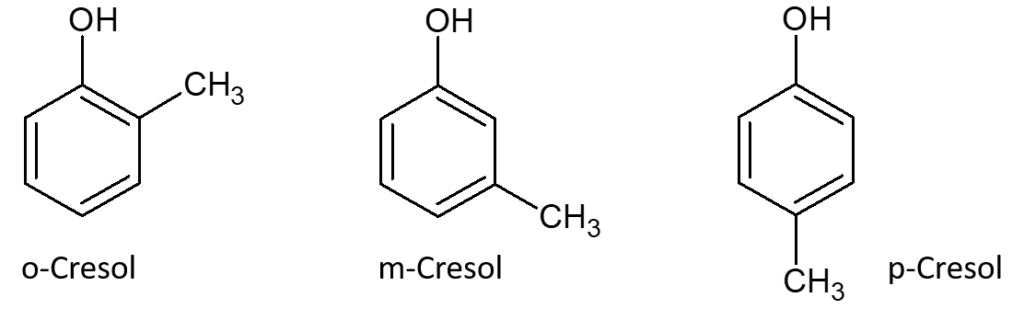
Zu den bedeutendsten Derivaten dieser aromatischen Stoffklasse zählen die Cresole, bei denen ein H-Atom im Phenol durch eine Methyl-Gruppe (= CH3) ersetzt ist. Von den Cresolen gibt es drei Stück; je nachdem, wo sich die CH3-Gruppe in Relation zur OH-Gruppe im Ring befindet. Es wäre auch zu schön gewesen, wenn es einfacher wäre. Doch sehen wir uns das mal genauer an: Hängt die CH3-Gruppe an dem C-Atom, das in direkter Nachbarschaft zum C-Atom mit der OH-Gruppe steht, heißt diese Verbindung ortho-Cresol. Ortho wird natürlich wieder abgekürzt, da der Chemiker nicht gerne so viel schreibt. Aus ortho wird „o“, also o-Cresol. Befindet sich die CH3-Gruppe im aromatischen Sechsring am nächsten C-Atom, spricht man vom meta-Cresol, oder m-Cresol. Und wenn sich die CH3-Gruppe direkt gegenüber der OH-Gruppe im Phenol befindet, dann erhält man das para-Cresol. Sie ahnen es, wir kürzen das als p-Cresol ab.
Keine Frage. Das waren jetzt eine Fülle an chemischen Informationen. Klar! Die wollen erst einmal verdaut werden. Doch ab jetzt wird es richtig spannend. Denn obwohl die drei Cresole strukturell sehr ähnlich sind, weisen sie deutliche Unterschiede im Aroma auf. So gilt das o-Cresol als „medizinisch“, während das m-Cresol als „rauchig“ sowie „gummiartig“ beschrieben wird und man das p-Cresol als „schwefelig“ mit „Geruch nach Abwasser“ bezeichnet. Doch die Cresole sind nur ein Teil der beim Verbrennen von Torf erzeugten und für die Aromatik des Malzes wichtigen Phenole. Auf uns wartet ein ganzes „Wunderwerk“ an Aromen und organoleptischen Eigenschaften, die sie bewirken. Und darauf dürfen Sie sich schon im nächsten Teil freuen. Bleiben Sie also dran!
Ihr/Euer
Whisky-Connaisseur
Heinz Weinberger